某容器中含有14.0gN2、16.0gO2、4.40gCO2时容器的压力为200kPa,计算各气体的分压和该容器得体积。
正确答案:
该容器中各气体的物质的量分别为:
各气体的摩尔分数为: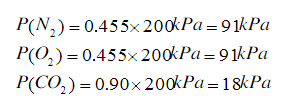

各气体的分压为:
根据气体状态方程pV = nRT得:

各气体的摩尔分数为:
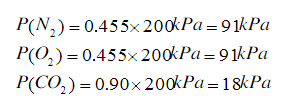

各气体的分压为:
根据气体状态方程pV = nRT得:

答案解析:有

微信扫一扫手机做题
某容器中含有14.0gN2、16.0gO2、4.40gCO2时容器的压力为200kPa,计算各气体的分压和该容器得体积。

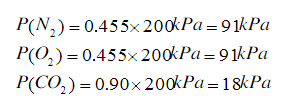



微信扫一扫手机做题