具有2.00×10-3mol/L碱度的水,pH为7.0,计算[HCO3]、[HCO3-]、[CO3-2]和[HO-]的浓度?
正确答案:
该条件下,[HCO3-]=碱度=2.00×10-3mol/L
在pH=7.00时,[H+]=[HO-]=1.00×10-7mol/L
根据;K1=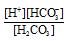 =4.45×10-7、[H+]和[HCO3-]浓度,求出[H2CO3]=4.49×10-4mol/L
=4.45×10-7、[H+]和[HCO3-]浓度,求出[H2CO3]=4.49×10-4mol/L
据K2= =4.68×10-11、[H+]、[HCO3-]浓度,求出[CO32-]=9.38×10-7mol/L
=4.68×10-11、[H+]、[HCO3-]浓度,求出[CO32-]=9.38×10-7mol/L
在pH=7.00时,[H+]=[HO-]=1.00×10-7mol/L
根据;K1=
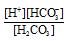 =4.45×10-7、[H+]和[HCO3-]浓度,求出[H2CO3]=4.49×10-4mol/L
=4.45×10-7、[H+]和[HCO3-]浓度,求出[H2CO3]=4.49×10-4mol/L据K2=
 =4.68×10-11、[H+]、[HCO3-]浓度,求出[CO32-]=9.38×10-7mol/L
=4.68×10-11、[H+]、[HCO3-]浓度,求出[CO32-]=9.38×10-7mol/L
答案解析:有

微信扫一扫手机做题
