背景材料:
阅读下列有关材料,按要求完成任务。
材料一《普通高中化学课程标准(实验)》的内容标准
举例说明化学能与电能的转化关系及其应用。认识提高燃料的燃烧效率、开发高能清洁燃料和研制新型电池的重要性。
材料二某版本教科书《化学2》(必修)的知识结构体系
第一章物质结构元素周期律
第二章化学反应与能量
第一节化学能与热能
第二节化学能与电能
第三节化学反应速率和限度
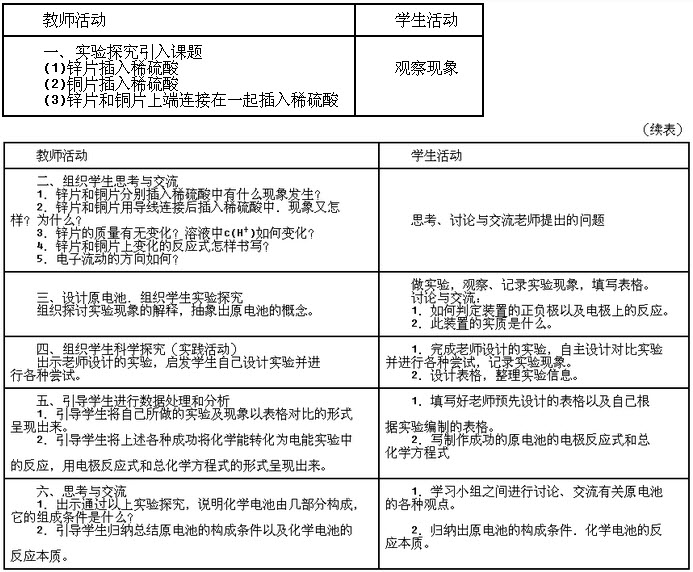
材料三【实验探究】铜片和锌片之间用一条导线连接(导线中间连入一个电流计),平行插入盛有稀硫酸溶液的烧杯中(图4),观察现象。 【学与问】根据所了解的电学知识,你知道电子是怎样流动的吗?你如何判定装置的正、负极。
【分析】当把用导线连接的锌片和铜片一同浸入稀硫酸中时,与铜的活动性比较,锌容易失去电子,被氧化成Zn2+进入溶液。电子由锌片通过导线流向铜片。溶液中的H从铜片获得电子被还原成氢原子,氢原子再结合成氢分子从铜片上选出。这一变化过程可以表示如下:
锌片:Zn-2e2+=Zn2+(氧化反应)
铜片:2H2++2e+=H2+↑(还原反应)
将化学能转变为电能的装置叫做原电池。
【实践活动】
目标:根据已具备的氧化还原反应知识和电学知识,利用提供的实验用品,设计一套电池装置。
用品:镁条、铜片、铁片、导线、金属夹、手电筒用小灯泡(或发光二极管)、果汁(橙汁、苹果汁、柠檬汁等)、电流表、500ml烧杯。
设计.并动手试验,边做边改进;也可以与邻座同学进行交流讨论。
设计及记录:
【学与问】根据所了解的电学知识,你知道电子是怎样流动的吗?你如何判定装置的正、负极。
【分析】当把用导线连接的锌片和铜片一同浸入稀硫酸中时,与铜的活动性比较,锌容易失去电子,被氧化成Zn2+进入溶液。电子由锌片通过导线流向铜片。溶液中的H从铜片获得电子被还原成氢原子,氢原子再结合成氢分子从铜片上选出。这一变化过程可以表示如下:
锌片:Zn-2e2+=Zn2+(氧化反应)
铜片:2H2++2e+=H2+↑(还原反应)
将化学能转变为电能的装置叫做原电池。
【实践活动】
目标:根据已具备的氧化还原反应知识和电学知识,利用提供的实验用品,设计一套电池装置。
用品:镁条、铜片、铁片、导线、金属夹、手电筒用小灯泡(或发光二极管)、果汁(橙汁、苹果汁、柠檬汁等)、电流表、500ml烧杯。
设计.并动手试验,边做边改进;也可以与邻座同学进行交流讨论。
设计及记录: 试说明化学电池应由哪几部分构成?
【小结】化学电池的反应本质--氧化还原反应。
试说明化学电池应由哪几部分构成?
【小结】化学电池的反应本质--氧化还原反应。
 针对原电池的构成条件、教学内容,根据上述材料完成下列任务:
问题: (1)确定三维教学目标; (2)确定教学重点和难点; (3)设计教学过程; (4)设计教学板书。
针对原电池的构成条件、教学内容,根据上述材料完成下列任务:
问题: (1)确定三维教学目标; (2)确定教学重点和难点; (3)设计教学过程; (4)设计教学板书。
知识与技能:
了解原电池的形成条件:了解铜锌稀硫酸原电池的工作原理;理解化学能与电能之间转化的实质;掌握化学能是能量的一种形式,它同样可以转化为其他形式的能量。
过程与方法:
通过反应物之间电子的转移的探究,理解原电池的形成是氧化还原反应的本质的拓展和运用。学会根据简单的氧化还原反应设计出一套原电池,并分析其工作原理。
情感·态度·价值观:
通过对设计原电池装置的必要性的研究,激发学生的环保意识,感悟研制新型电池的重要性以及化学电源可能会引起的环境问题,形成较为客观、正确的能源观,提高开发高能清洁燃料的意识。
(2)教学重点与难点
教学重点:
初步认识原电池概念、原理、组成及应用。
教学难点:
通过对原电池实验的研究.引导学生从电子转移角度理解化学能向电能转化的本质,以及这种转化的综合利用价值。
(3)教学过程
(4)教学板书
第二节化学能与电能
一、化学能与电能的相互转化
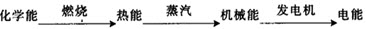
1.燃煤发电的过程
2.燃烧的本质--氧化还原反应
3.原电池
(1)原电池的定义--将化学能转变为电能的装置叫做原电池。
(2)原电池的电极
负极:发生氧化反应,电子流出(流向正极)的一极。
正极:发生还原反应,电子流入(来自负极)的一极
(3)组成原电池的条件
①有两种活动性不同的金属(或一种是非金属导体)作电极。
②电极材料均插入电解质溶液中(能自发进行氧化还原反应)。
③两极相连形成闭合电路。
(4)原电池的原理
较活泼的金属发生氧化反应,电子从较活泼的金属(负极)流向较不活泼的金属(正极)。
【小结】化学电池的反应本质--氧化还原反应

微信扫一扫手机做题
